人民金融·创新药指数涨0.74% | 瑞德西韦新冠适应症再扩大 国产口服版在上海和香港临床试验
一度被称作“人民的希望”的瑞德西韦,最近带来了不少希望。近日,瑞德西韦获FDA授权扩大治疗范围至12岁以下人群,并被WHO有条件地推荐用于治疗有高度住院风险的非重症COVID-19患者。与此同时,多家企业在加快口服版瑞德西韦的研发,进展最快的VV116在4月初启动与辉瑞Paxlovid的头对头三期试验,又将在香港开始临床试验。
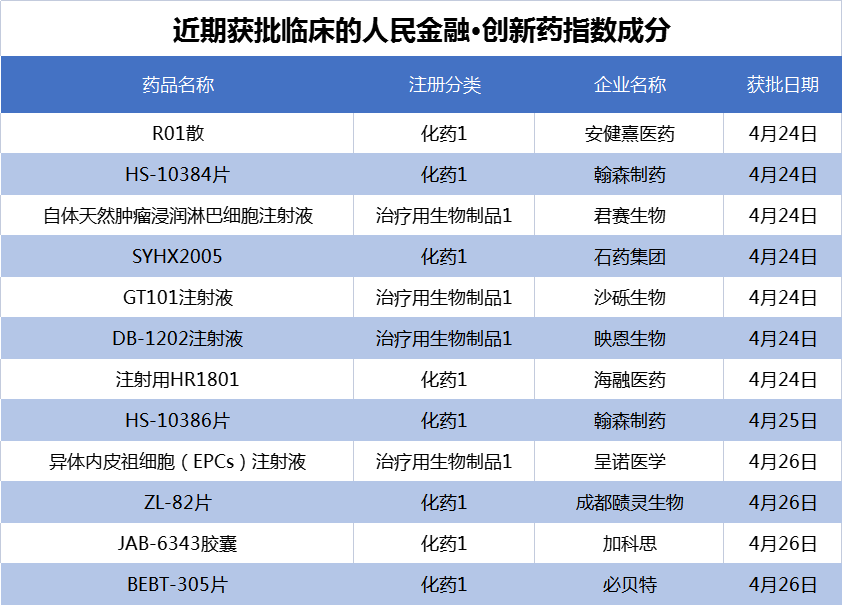
在4月22日至4月28日的新发布周期内,京新药业的1类新药安达西尼胶囊报产,成为公司首个申请上市的小分子创新药;来自石药集团、翰森制药、加科思等的12个创新药项目首次获批临床,我们将其纳入了“人民金融·创新药指数”。
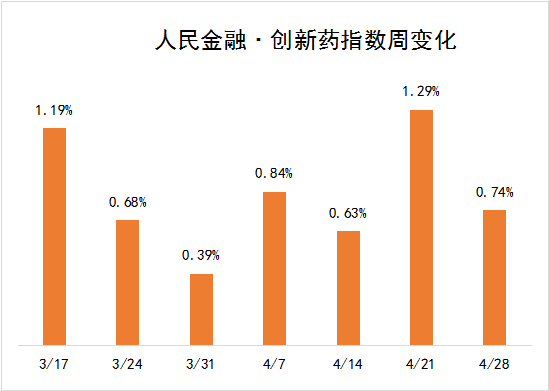
临床进展方面,科伦药业的Trop2 ADC新药SKB264、前沿生物的新冠小分子药物FB2001即将启动注册临床。受这些因素推动,新发布周期内,“人民金融·创新药指数”上涨了0.74%,最新报2619点。
口服版瑞德西韦研发加速推进
4月25日,美国食品药品监督管理局(FDA)扩大了Veklury(瑞德西韦)的适用范围,将28天及以上、体重至少3公斤且新冠病毒阳性结果的儿童患者纳入其中。这意味着,瑞德西韦成为第一个获批用于12岁以下儿童的抗新冠疗法。此前,瑞德西韦已被批准用于治疗12岁及以上、体重至少40公斤的住院新冠患者。
也是最近,瑞德西韦的疗效获得了WHO的认可。在4月21日更新的《疗法与COVID-19:动态指南》中,WHO有条件地推荐瑞德西韦用于治疗有高度住院风险的非重症COVID-19患者。此前,WHO不建议对任何程度的新冠住院患者使用瑞德西韦,甚至一度曾称其几乎无效。
对此,吉利德表示,WHO指南的更新认可了瑞德西韦在帮助COVID-19疾病进展高危人群中的重要作用,不过,目前其尚未如全球的其他一些治疗指南那样全面体现出瑞德西韦针对不同程度患者的广泛有效性证据。
据吉利德介绍,瑞德西韦已受到全球40多个国家和地区的多项重要指南推荐,用于轻、中度和重度COVID-19患者的治疗。目前,美国一半以上因COVID-19住院的患者接受了瑞德西韦治疗。瑞德西韦及其仿制药已惠及全球1100万名患者,这其中包括来自127个中低收入国家和地区的700万名患者。
某种程度上,瑞德西韦确实称得上“人民的希望”。在有效性上,瑞德西韦接近辉瑞口服药Paxlovid.吉利德4月24日公布的PINETREE研究表明,症状出现5天内接受瑞德西韦治疗的患者住院风险降低了90%;症状出现5天后接受瑞德西韦治疗的患者住院风险降低了81%。同时,多项独立研究的体外实验室测试表明,瑞德西韦针对不断变异的SARS-CoV2展示出持久活性,包括奥密克戎变异株及其亚型变异株BA.1和BA.2。
不过,瑞德西韦的缺点也很明显,其静脉注射的使用方式在依从性上较口服药差,这无疑是影响瑞德西韦可及性的重要因素。
因此,研发可口服且疗效更好的改良药十分有必要。目前,不少药企已开启了口服版瑞德西韦的研发,包括吉利德、君实生物、科兴制药等。
其中,君实生物与旺山旺水合作的VV116为瑞德西韦的口服氘代版,正在开展针对轻中度和中重度新冠肺炎患者的国际多中心三期临床研究。
4月28日,香港中文大学网站的消息,VV116将在香港开始临床试验。本次研究将招募2000名18岁或以上最近确诊的新冠患者,是香港首个新冠口服药大型临床研究。在业内人士看来,此前VV116的轻中度国际多中心三期临床进度缓慢,宣布在香港启动临床后,受试者入组有望加快。
同时,VV116正在上海开展与辉瑞Paxlovid的头对头试验。据我们了解,在正常的三期临床试验之外,由宁光院士牵头,VV116正在上海瑞金医院、公卫中心和浦东医院等进行与辉瑞Paxlovid头对头的试验,主要针对轻中度新冠患者。这项试验,受试者规模为800人,4月底将完成给药,随后有14天和28天两个观察期,如果效果不差于辉瑞Paxlovid,将直接申请紧急使用授权。
作为瑞德西韦的原研方,吉利德也开始了口服版瑞德西韦的研发。目前,吉利德正在研发一款名为GS-5245的瑞德西韦前药,该药在体内可迅速转化为瑞德西韦。吉利德网站显示,GS-5245正处于I期临床阶段。
和VV116类似,科兴制药与安泰维合作的新冠口服药SHEN26也是瑞德西韦的改良版本。据报道,SHEN26活性是瑞德西韦的4.7倍,目前处于临床前研究阶段。科兴制药4月28日在投资者互动平台表示,公司计划在SHEN26Ⅰ期临床研究结束后开展Ⅱ/Ⅲ期国际多中心研究。
京新药业首个1类新药报产
4月24日,京新药业的1类新药安达西尼胶囊(研发代号:EVT201)申报上市,用于治疗失眠障碍。这是京新药业的首个小分子创新药上市申请,标志着公司创新药研发取得了里程碑进展。
据介绍,安达西尼胶囊是GABAA受体的部分正向别构调节剂,选择性作用于GABAA受体α1亚型,表现出高的亲和性和中等强度的激动作用,可诱导快速入睡和维持睡眠。公司于2021年11月完成该药品的Ⅲ期临床试验,达到主要终点和次要终点,并于2022年3月向药监局递交上市申请。
此前,安达西尼胶囊治疗失眠障碍的随机、双盲、安慰剂对照、多中心3期临床研究主要研究终点结果达到方案预设的优效标准。研究结果表明,安达西尼胶囊可以显著延长失眠患者的总睡眠时间。
目前失眠障碍治疗药物主要包括地西泮、氯硝西泮等在内的苯二氮卓类,以及唑吡坦(国内1995年上市)、右佐匹克隆(国内2007年上市)为代表的新型非苯二氮卓类。此后,国内无新药获批上市。
京新药业在年报中表示,EVT201胶囊获批上市后,将丰富CNS管线创新药产品,提高核心领域竞争力,推动京新创新转型。
12个创新药项目首次获批临床
在新发布周期内,来自石药集团、翰森制药、加科思等的12个创新药项目首次获批临床,包括8款化药、4款生物药。
其中,石药集团的SYHX2005和加科思的JAB-6343胶囊均属于高选择性FGFR4(成纤维细胞生长因子受体4)抑制剂,分别于24日和26日获批临床。
据悉,FGFR为目前“不限癌种”疗法聚焦的热门靶点之一,正吸引越来越多制药企业布局。就高选择性FGFR4及通路而言,目前无已上市的FGFR4抑制剂,全球范围内仅有少数处于不同临床开发阶段的候选药物,国内在研的FGFR4抑制剂还有诺诚健华的ICP-105、海正药业的HS236、贝达药业的BPI-43487、首药控股的SY-4798等,目前这些项目均处于临床I期阶段。
君赛生物的GC101 TIL和沙砾生物的GT101注射液均为TIL(肿瘤浸润淋巴细胞)疗法,两个新药项目前后脚获批临床。
TIL细胞疗法从新鲜肿瘤组织中分离与富集肿瘤杀伤性细胞,经体外功能修复与规模扩增,通过静脉回输到患者体内发挥抗肿瘤效果,已在多种类型晚期实体瘤上展现高比例、长持久性的客观缓解疗效,被认为是最具潜力的实体瘤疗法之一。目前国内TIL细胞疗法正在升温,除君赛生物和沙砾生物的TIL细胞疗法在国内获批临床外,劲风生物的TIL治疗产品在今年2月已经获美国FDA批准进入临床I期。
临床进展方面,4月26日,科伦药业在Clinicaltrials.gov网站上登记了Trop2 ADC新药SKB264治疗三阴乳腺癌的三期临床试验。这意味着,SKB264成为首个进入注册临床的国产TROP2-ADC.4月27日,前沿生物宣布,其新冠小分子药物FB2001获批开展Ⅱ/Ⅲ期国际多中心临床试验,FB2001 拟开展国际多中心Ⅱ/Ⅲ期临床试验。(知蓝)
(文章来源:证券时报网)
本文来源于网友自行发布,不代表本站立场,转载联系作者并注明出处
